Publicado el: 13/4/2020
Autor/es: César Quintero
 Resumen
Resumen
La fertilización foliar o la nutrición de las plantas a través de las hojas es un tema que se conoce desde hace más de cien años. Sin embargo, la técnica de fertilización foliar es mucho menos utilizada que la de aplicación de fertilizantes al suelo para ser absorbidos por las raíces. Esto, como muchas otras cosas, puede ser debido a un mayor desconocimiento de esta práctica.
Una revisión bibliográfica en los buscadores de trabajos científicos como SCOPUS muestra que el tema “fertilización foliar” viene produciendo resultados crecientes. Hace 10 años se publicaban unos 100 trabajos por año, hace cinco unos 150 y actualmente más de 200 reportes o publicaciones científicas sobre el tema. La mayoría de los estudios se enfocan en los mecanismos de absorción. El nutriente más estudiado es el nitrógeno (N), seguido del zinc (Zn), el boro (B) y el hierro (Fe). Los cereales son los cultivos más estudiados, pero existen muchos informes sobre otros cultivos, frutales y cítricos (Woogt et al., 2013).
La aplicación foliar de nutrientes es una estrategia importante de manejo para maximizar los rendimientos de los cultivos que puede complementar la fertilización del suelo. Cuando los nutrientes se aplican a los suelos, son absorbidos por las raíces de las plantas y se trasladan a las partes aéreas. En caso de aplicación foliar, los nutrientes penetran en la cutícula de la hoja o los estomas y luego ingresan a las células. Por lo tanto, la respuesta del cultivo ocurre en poco tiempo en la aplicación foliar en comparación con la aplicación al suelo (Fageria et al., 2009).
Bases fisiológicas para la fertilización foliar
Las plantas que cultivamos evolucionaron hacia un medio terrestre y desarrollaron toda una estructura anatómica, fisiológica y morfológica para absorber el agua y los minerales por las raíces desde el suelo y, por otro lado, evitar la deshidratación en la parte aérea expuesta al aire como las hojas. Por lo cual, es lógico y razonable pensar que la vía natural de absorción de los nutrientes minerales es a través de las raíces. Sin embargo, no hay que olvidar que los primeros vegetales existieron en un medio acuático y absorbían los nutrientes y el agua a través de toda su piel; y esta capacidad no se ha perdido.
La fertilización tradicional al suelo es la más utilizada y racionalmente aceptada. Los nutrientes que ponemos en el suelo con los fertilizantes deben sobrellevar una serie de pasos o procesos para que finalmente lleguen al interior de la planta y ejerzan su acción metabólica. Normalmente, los fertilizantes en el suelo se deben disolver, moverse hasta las raíces, ser absorbidos y translocados hasta el punto de crecimiento de la planta. En todo este camino a través del suelo y de la planta, el nutriente puede perderse (volatilizarse, lixiviarse, lavarse); formar compuestos insolubles (precipitar, adsorberse) y no todo lo aplicado es aprovechado. Debido a esto es que la eficiencia de uso de los fertilizantes tradicionales no es lo que uno quisiera. En el caso de la fertilización de cereales con N, se sabe que la eficiencia de utilización del N es inferior al 50%. Para el caso del fósforo (P), que interactúa muy fuertemente con los sólidos del suelo, la eficiencia de utilización es mucho más baja aún. Esto ha llevado, en algunos países, al uso de dosis de fertilizantes elevadas y consecuentemente a la contaminación de suelos y aguas (Fernández et al., 2013). La fertilización foliar surge hoy entonces como una alternativa más amigable con el ambiente dado que el nutriente colocado directamente sobre el tejido vegetal, durante el período crítico de requerimiento, tendría una eficiencia de utilización muy superior (Marschner, 2012).
Dicho así parece fácil, pero el nutriente en primer lugar debe llegar a la superficie de la hoja, permanecer en una forma soluble como para luego ser absorbido y translocado al sitio de acción. Es decir que se deben considerar todas las recomendaciones y desarrollos tecnológicos para que esto sea posible. La aplicación de un nutriente por vía foliar debe ser de muy alta calidad (tamaño de gotas y número de impactos por superficie) para lograr cobertura sobre la hoja, pero además debe estar protegido para resistir la degradación, el desecamiento y el lavado en caso de lluvia.
Las plantas están cubiertas por una cutícula de cera hidrófoba que controla la pérdida de agua, solutos y gases con el medio ambiente, y a la inversa también impide su entrada sin restricciones en el interior de la planta. Las características estructurales y químicas de la superficie de la planta hacen que sea difícil la humectación y, por lo tanto, la permeación por una solución nutritiva polar como el agua, aplicada en la superficie. Sin embargo, hoy sabemos que las superficies de las plantas son permeables a las soluciones de nutrientes. La facilidad con la que una solución de nutrientes puede penetrar en el interior planta dependerá de las características de la superficie de la planta, que pueden variar con el órgano, especie, variedad y condiciones de cultivo. Las estructuras epidérmicas, tales como estomas y lenticelas, que puede estar presentes en hojas y frutos, son permeables a las soluciones aplicadas en la superficie y pueden desempeñar un papel significativo en su absorción. Se han encontrado sustancias apolares lipofilicas capaces de cruzar las cutículas mediante un proceso de solución-difusión.
Dado que las superficies de las plantas son hidrófobas en mayor o menor grado, las soluciones de nutrientes en agua pura (no formulado) están limitadas en su absorción por el follaje. Por lo tanto, es importante utilizar formulaciones foliares con adecuadas formas de nutrientes y adyuvantes para que la eficacia global de los fertilizantes foliares pueden ser optimizada. Los factores ambientales como la humedad relativa y/o la temperatura afectan las propiedades físicas y la eficacia de una formulación fertilizante foliar y estos deben ser tenidos en cuenta antes de aplicar los tratamientos de pulverización.
Las especies cultivadas difieren notablemente en las características de las superficies de las hojas y por lo tanto, la predicción de la respuesta del cultivo a cualquier formulación es imposible en la actualidad. El medio ambiente afecta a todos los aspectos de la fertilización foliar; desde las reacciones físicas y químicas del caldo de pulverización; a la arquitectura de la planta; la composición cuticular de hojas; y el destino de los nutrientes una vez que entran a la planta. La fenología de la planta también tiene un gran efecto sobre la composición cuticular y, por lo tanto, la eficacia de la fertilización foliar.
La movilidad de un elemento nutriente en el floema tiene un profundo efecto sobre la capacidad de las plantas para absorber, trasladar y beneficiarse de fertilizantes foliares y por lo tanto tiene un papel importante en la determinación de su eficacia. La aplicación foliar de nutrientes floema-inmóviles (Ca-B-Mn-Si) sólo benefician a los tejidos que reciben directamente la pulverización foliar. La aplicación foliar de nutrientes móviles (N-P-K-S-Mg) tiene el potencial para el beneficio sistémico y de largo alcance. Las limitaciones a la cantidad de nutrientes que se puede aplicar y la rápida dilución de los nutrientes aplicados debida a la movilización dentro de la planta reducen el potencial beneficio de aplicaciones foliares de nutrientes-floema móvil. Algunos nutrientes tienen movilidad intermedia o restringida (Fe-Zn-Cu-Mo). Pero para todos los nutrientes (móviles e inmóviles), el papel más relevante de la fertilización foliar es prevenir deficiencias inmediatas y transitorias que no se pueden abordar de forma rápida por aplicaciones al suelo.
Las interacciones entre la fenología del cultivo y el medio ambiente pueden determinar la utilidad de la fertilización foliar.
¿Cuándo se dan condiciones oportunas para la fertilización foliar?
Fernández et al. (2013) enumeran las condiciones ventajosas en las cuales la fertilización foliar puede ser exitosa:
- Cuando el abastecimiento de algunos nutrientes por parte del suelo es deficiente y no se ha fertilizado adecuadamente por la vía tradicional. La deficiencia de nutrientes no fue detectada o considerada previamente o la fertilización fue desbalanceada. También cuando el suelo tiene condiciones que limitan la disponibilidad de nutrientes como el pH alto o gran fijación o adsorción de elementos como el P, o son muy arenosos.
- En algunas circunstancias, los períodos de pico crecimiento de los cultivos inducen a una demanda de nutrientes que excede el suministro de nutrientes incluso en un suelo fértil o bien fertilizado. La demanda de nutrientes para el rápido crecimiento de la fruta o de llenado de granos puede exceder la capacidad de absorción de la planta o el abastecimiento del suelo. La competencia entre las raíces y brotes durante los períodos de alta demanda puede reducir la asignación de carbohidratos a las raíces y restringir el crecimiento de las raíces su metabolismo y, por lo tanto, también reducir la adquisición de nutrientes.
- En los frutales, durante principios de la primavera, cuando muchas especies de hoja caduca florecen y fructifican y la humedad o temperatura del suelo no son favorables para la absorción de nutrientes del suelo.
- La arquitectura de la planta y el desarrollo de órganos crean una demanda local de nutrientes que excede la capacidad de entrega o transporte dentro de la planta. Las limitaciones en el transporte de elementos del floema-inmóviles a órganos con conectividad vascular inadecuada o baja transpiración; como por ejemplo, deficiencias de B o Ca en frutas y órganos carnosos. También deficiencias de B, Cu, Fe, Zn en estructuras reproductivas (fertilización floral).
- Biofortificación de cultivos. Especialmente para mejorar el contenido de Fe y Zn en los granos y su biodisponibilidad como alimentos.
Dada la gran complejidad de interacciones y las incertidumbres teóricas que rigen aún sobre la fertilización foliar, los ensayos de campo y las pruebas en ambientes controlados seguirán desempeñando un papel fundamental en la adaptación de la teoría a la práctica en el terreno. Igualmente importante es reconocer que los resultados obtenidos de los ensayos de campo no pueden generalizarse sin considerar las condiciones específicas que prevalecieron durante el ensayo y las características del cultivo utilizado.
La fertilización foliar actualmente se está acoplando o asociando con la aplicación de productos bioestimulantes. Los bioestimulantes vegetales son sustancias o materiales (con la excepción de los nutrientes y pesticidas) que, cuando se aplican a las plantas, semillas o sustratos en formulaciones específicas, tienen la capacidad de modificar los procesos fisiológicos en las plantas de una manera que ofrecen beneficios potenciales para el crecimiento, el desarrollo, o la respuesta al estrés. Esta definición incluye una variedad de sustancias como extracto de algas, sustancias húmicas, aminoácidos y bacterias promotoras del crecimiento. Los bioestimulantes han demostrado que aumentan la absorción de nutrientes bajo ciertas condiciones, lo que sugiere su utilidad en la reducción del uso de fertilizantes sin afectar negativamente el rendimiento.
¿Sirve el análisis de plantas? ¿Cómo lo utilizo?
El análisis de tejidos vegetales es útil para conocer el estado nutricional de los cultivos, confirmar síntomas, hacer recomendaciones, etc. Se los utiliza desde hace muchos años, pero en mucha menor medida que el análisis de suelos. Correndo y García (2012) presentan una descripción de la utilidad de los análisis vegetales como herramienta de diagnóstico. Remarcan la importancia del muestreo y la interpretación de los resultados.
Generalmente se hace una analogía con el análisis de suelos y se cree que se puede tomar una muestra de tejidos, hacer un diagnóstico y una recomendación de fertilización; lo cual no está del todo errado. Sin embargo, en los cultivos anuales se recomienda tomar las muestras de hojas al inicio de la etapa reproductiva de floración. El tiempo entre que se toman las muestras, llegan al laboratorio y se obtienen los resultados, puede extenderse entre 15 y 30 días. Esto determina que la oportunidad de corrección por fertilización foliar en estos casos pueda ser tarde. Sin embargo, el seguimiento sistemático del estado nutricional de los cultivos mediante análisis foliares, permite detectar deficiencias o desbalances, que son frecuentes en algunas condiciones, situaciones o regiones y corregirlas dentro del plan de fertilización (Arévalo, 2015; Grasso y Diaz-Zorita, 2018) .
Un ejemplo de su utilidad se puede apreciar en la Tabla 1 que presentan Grasso y Díaz-Zorita (2018). En maíz, el 54% de los casos evaluados presentaron niveles insuficientes de N, 56% de P y 65% de S. En soja, el 52% de los casos con limitaciones de P y 31% de S. En el caso de las gramíneas de invierno, sólo en cebada encontraron potenciales limitaciones en el 25% de los casos con P y 38% de casos con S.
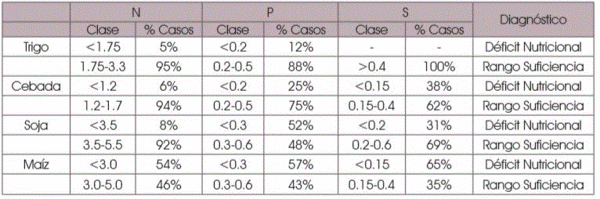
Tabla 1. Proporción de casos con deficiencias o suficiencia de nutrientes en base a 900 análisis de tejidos foliares según resultados compilados por Fertilizar AC en la región pampeana. Los rangos de suficiencia corresponden a Correndo y Garcia (2012).
Otro caso que es un ejemplo interesante de la utilización de los análisis foliares lo presenta Arévalo (2015). Sobre más de 100 muestras de hojas de soja tomadas en la zona núcleo, aplicando la metodología DRIS, encuentra que para los sistemas de producción de Argentina, el nutriente que limitó mayormente el rendimiento fue el azufre, le siguen nitrógeno, magnesio y potasio. Entre los micronutrientes, cobre y zinc fueron los más deficientes, mientras que manganeso, en general se presentó desde suficiente a excesivo en nuestro país.
¿Qué utilidad tienen estos análisis? El haber realizado análisis de tejidos vegetales no implica que debamos hacer una fertilización foliar. Nos ayuda a planificar la estrategia de fertilización en los próximos años. Los ejemplos colocados más arriba nos muestran que estamos dosificando con bajas cantidades de P y S fundamentalmente; que nutrientes que ni consideramos (como el K) pueden encontrarse en niveles insuficientes. Algunos micronutrientes también pueden ser deficitarios.
Entonces, ¿qué pasa? Si no fertilizamos adecuadamente de manera tradicional, porque el campo es arrendado o por otra razón empresarial o personal, los cultivos presentarán deficiencias que serán severas o importantes en los períodos de máximo crecimiento y entonces tenemos potencial de respuesta a la fertilización foliar.
¿Que expectativa de respuesta a la fertilización foliar tenemos?
Dado que la posibilidad de aplicar nutrientes por las hojas tiene limitaciones fisiológicas en las
cantidades a colocar en cada aplicación (por la fitotoxicidad) y económicas (dados los costos de la aplicación) que reducen el número de aplicaciones. Las expectativas de respuestas son proporcionales a las cantidades aportadas respecto a la demanda. Las cantidades de macronutrientes que se pueden aplicar en una sola vez es de pocos kg ha-1, normalmente menos de 10 kg ha-1 para N o de 1 a 2 kg ha-1 para P, dependiendo del volumen de caldo. Para los micronutrientes es posible aplicar desde 100 g ha-1 hasta 1 kg ha-1 o más. Para los macroelementos es muy difícil cubrir la demanda total por fertilización foliar; pero en el caso de micronutrientes es factible (Tabla 2).
cantidades a colocar en cada aplicación (por la fitotoxicidad) y económicas (dados los costos de la aplicación) que reducen el número de aplicaciones. Las expectativas de respuestas son proporcionales a las cantidades aportadas respecto a la demanda. Las cantidades de macronutrientes que se pueden aplicar en una sola vez es de pocos kg ha-1, normalmente menos de 10 kg ha-1 para N o de 1 a 2 kg ha-1 para P, dependiendo del volumen de caldo. Para los micronutrientes es posible aplicar desde 100 g ha-1 hasta 1 kg ha-1 o más. Para los macroelementos es muy difícil cubrir la demanda total por fertilización foliar; pero en el caso de micronutrientes es factible (Tabla 2).
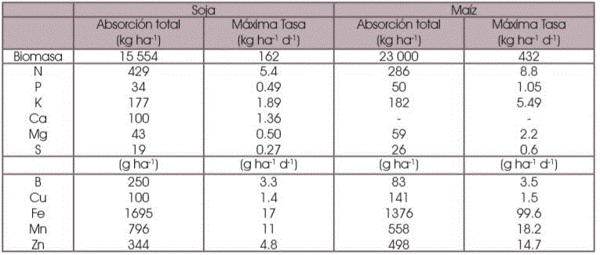
Tabla 2. Acumulación de nutrientes en cultivos de alto rendimiento. Soja con promedio de ensayos de 6.6 tn ha-1 (Bart, et al. 2018) y Maíz con rendimiento medio de granos 12.2 tn ha-1 (Bender, et al. 2013).
La aplicación de 5 a 10 kg ha-1 de N por vía foliar en soja en R3 frente a un consumo potencial de 429 kg ha-1 parece muy poco relevante. Sin embargo. los ensayos de Moreira et al. (2017) durante 3 años en Brasil mostraron un promedio de rendimiento de 4257 kg ha-1 para el testigo sin N, con 5 kg ha-1 de N foliar 4468 kg ha-1 y con 10 kg ha-1 de N foliar 4510 kg ha-1 de granos. Esto es un 5% a 6% de respuesta (200-250 kg ha-1) estadísticamente significativa. La cantidad aplicada por vía foliar cobra relevancia en comparación con la tasa de absorción diaria de N (Tabla 2). En el momento de máxima tasa de absorción, el sistema suelo-soja-rizobio no puede satisfacer la demanda. Los hallazgos de este estudio se encuentran en línea con lo informado por Cafaro La Menza et al. (2017) quienes indican que el N limita el rendimiento de la soja en ambientes con alto rendimiento potencial, donde las fuentes indígenas de N parecen insuficientes para satisfacer completamente los requisitos del N de cultivo. La respuesta a la fertilización con N puede ocurrir por encima de un umbral de 2500 kg ha-1 de rendimiento potencial y sería de hasta 250 kg ha-1.
En el caso de cereales como el trigo, el uso de N foliar puede incrementar el rendimiento y mejorar la calidad del grano. Esto se puede apreciar en un ensayo realizado en Pergamino sobre 9 cultivares de trigo y dos de cebada (Ferraris y Arias Usandivaras. 2018). El testigo fertilizado de manera tradicional con 100 kg ha-1 de SPT más 120 kg ha-1 de urea rindió en promedio 4630 kg ha-1 con 10.9% de proteína. Mientras que al que se le agregó 10 kg ha-1 de N foliar rindió 5250 kg ha-1 con 11.4%. Esto significa una respuesta en grano de 13% y de proteína de 19%.
Si bien en el caso de los micronutrientes es posible cubrir la demanda total por vía foliar, dado que la respuesta a estos elementos menores es relativamente baja, el aumento de rendimiento por fertilización foliar con micronutrientes es del orden de 5% a 15% normalmente. Uno de los elementos que más generalizada y consistente respuesta muestra en la región pampeana es el Zn. Las aplicaciones foliares de Zn han mostrado buenas respuestas en arroz, maíz, soja y otros cultivos.
Conclusión
Los fertilizantes foliares podrían mejorar los rendimientos en ambos casos. Sobre todo si se aplican como complemento o como aporte extra que se suma a la fertilización que se realiza actualmente.
En los cultivos anuales de grano, la fertilización foliar puede ser beneficiosa cuando existen deficiencias claras de algún elemento como Zn o N y cuando las aplicaciones coinciden con el inicio del período de mayor demanda de nutrientes.
Fuente: Engormix















