Sistemas agrícolas del Cono Sur de Latinoamérica: Impactos en la calidad de los suelos
Publicado el: 25/08/2017
Autor/es: Dr. Fernando García y Adrián Correndo. International Plant Nutrition Institute (IPNI)– Programa Latinoamérica Cono Sur. Buenos Aires, Argentina
Introducción
La creciente demanda global de alimentos, forrajes, fibras, biocombustibles y biomateriales se atribuye al sostenido crecimiento demográfico, la escasez de tierras agrícolas, y al fuerte crecimiento de los países emergentes (China e India, principalmente), con una creciente urbanización e incorporación de personas a la clase media (Adámoli, 2013). La ONU ha estimado una población superior a 9 mil millones de habitantes para el 2050, siendo los países en vías de desarrollo los que contribuirán en mayor medida a ese aumento. Asimismo, se estima que el 70% de la población será urbana hacia 2050, comparada con aproximadamente un 50% en el 2010 (Buhaug y Urdal, 2013). A su vez, se asocia un cambio en las dietas alimenticias con previsión de incrementos en el consumo de carnes, leche y aceites vegetales.
Entre 1961 y 2010, la población mundial creció más del doble, pero el incremento de la producción global de alimentos fue superior, a pesar de una reducción del 50% en el área cultivable por persona, registrándose un aumento en la producción anual per cápita del 16% (Vilella y Renis, 2013). Sin embargo, los incrementos en producción y productividad han sido muy heterogéneos, y la distribución de alimentos y otros productos de la agricultura entre la población mundial sigue siendo limitante para muchas regiones y áreas de un mismo país. El crecimiento en producción y productividad registrado en los últimos 50 años ha generado costos y externalidades negativas a nivel económico, social y ambiental. El desafío para la humanidad es reducir el impacto de estos costos y externalidades y evitar que los mismos se amplifiquen y/o que se sumen nuevos a los ya existentes (Rockstrom et al., 2009; Sutton et al., 2013). A este desafío se suma el cambio climático y su potencial impacto en la producción y en los recursos naturales, económicos y sociales (St. Clair y Lynch, 2010; Magrin, 2013; Wheeler y von Braun, 2013).
Los suelos son esenciales para lograr seguridad alimentaria siendo responsables del abastecimiento del 95% de los alimentos a nivel mundial. Sin embargo, esta es solo una de las numerosas funciones que cumplen, FAO (2015) ha incluido las siguientes funciones para los suelos:
• Suministro de alimentos, fibras y combustibles
• Retención de carbono
• Purificación del agua y reducción de contaminantes del suelo
• Regulación del clima
• Ciclo de nutrientes
• Hábitat para organismos
• Regulación de inundaciones
• Fuente de productos farmacéuticos y recursos genéticos
• Base para las infraestructuras humanas
• Suministro de materiales de construcción
• Herencia cultural
Estimaciones del Programa Ambiental de Naciones Unidas (UNEP, 2014) indican que, para satisfacer las demandas de alimentos bajo las condiciones actuales y considerando una 1 población de 9-12 mil millones de habitantes para el 2100, se necesitaría expandir las áreas bajo cultivo entre 71 y 300 millones de ha. La expansión de la agricultura hacia áreas aún no explotadas a través de la deforestación e incorporación de ecosistemas más frágiles, constituye una severa amenaza a la sostenibilidad de los sistemas, por lo que las alternativas propuestas incluyen:
• Promover el consumo de vegetales
• Reducir el desperdicio de alimentos
• Mejorar la planificación de uso de las tierras
• Recuperar tierras degradadas
• Aumentar la productividad en tierras bajo cultivo
• Controlar el consumo de biomateriales y biocombustibles
Entre estas alternativas, impulsar el crecimiento de la productividad en las tierras actualmente en uso ha sido considerada por varios autores y proyectos (Alexandratos y Bruinsma, 2012; www.yieldgap.org). En Argentina, se han estimado brechas de rendimiento entre los actuales y los alcanzables en secano del orden del 32%, 41% y 41% para soja, maíz y trigo, respectivamente (Aramburu Merlos et al., 2015).
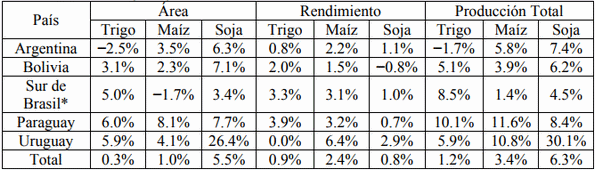
En la agricultura del Cono Sur, la producción de granos ha crecido sostenidamente en los últimos 20 años; gran parte se debe a la expansión del área bajo cultivo y, en menor medida, a aumentos en los rendimientos (Wingeyer et al., 2015). Soja, maíz y trigo representaron el 63%, 19% y 12%, respectivamente, del total del área sembrada en 2012 en los países de la región del Cono Sur (Argentina, Bolivia, Paraguay, sur de Brasil y Uruguay) según FAOSTAT (http://faostat.fao.org/). Las tasas de cambio en área cultivada, rendimiento, y producción total han sido diferentes para estos cultivos y países (Tabla 1). En general, la soja se expandió a expensas de otros cultivos y por el cambio de uso de la tierra. Esta expansión se ha basado en la adopción de la siembra directa (70-90% en la región del Cono Sur) y las variedades resistentes de glifosato, pero especialmente por los mayores precios relativos de la soja con respecto a otros granos (Wingeyer et al., 2015).
Tabla 1. Tasas de cambio anual en área, rendimiento y producción de trigo, maíz y soja en Argentina, Bolivia, sur de Brasil, Paraguay, y Uruguay en el periodo 1994-2013. Fuente: Wingeyer et al. (2015).

* Incluye los estados de Paraná, Santa Catarina y Rio Grande do Sul.
Como resultado de la expansión del monocultivo (principalmente soja), la escasa biodiversidad de cultivos (falta de rotaciones, eliminación de pasturas), la expansión hacia ecosistemas frágiles, el bajo uso de nutrientes y los cambios en tenencia de la tierra; la expansión de la agricultura en el Cono Sur ha generado impactos negativos en la salud y conservación de los suelos, entre ellos:
• Erosión eólica e hídrica
• Desertificación • Agotamiento de la materia orgánica
• Pérdida de nutrientes
• Compactación
• Salinización/Alcalinización
• Pérdida de biodiversidad
• Contaminación por uso inadecuado de insumos
Incrementar la producción a través del aumento de los rendimientos para evitar la expansión a ecosistemas frágiles y reducir los impactos negativos en salud y conservación de suelos requiere la incorporación de mejores prácticas de manejo de suelos y cultivos. En este marco, la “intensificación ecológica” se conceptualiza como una alternativa de producción con mínimo impacto ambiental y social a partir del uso más eficiente y efectivo de los recursos e insumos, y no a partir del mayor uso de los mismos (Cassman et al., 1999; Caviglia y Andrade, 2010).
Para ello es necesario disponer de tecnologías de procesos y de insumos probadas científicamente para producir más granos, fibras, y/o forraje en la misma unidad agrícola en un periodo de tiempo determinado haciendo un uso más eficiente y efectivo de recursos como la radiación, el agua y los nutrientes disponibles, y de insumos como combustibles, maquinarias, semilla, fertilizantes y pesticidas.
Este concepto de intensificación sustentable requiere del desarrollo de sistemas de producción diversificados, de mayor producción y mejor calidad de productos, con integración de las cadenas productivas que provean a un mayor valor agregado, control de los impactos ambientales y sociales negativos como la erosión o la contaminación difusa, gestión eficiente y efectiva de recursos limitados como el agua, reciclado responsable, y manejo especifico por sitio para optimizar la eficiencia de uso de los recursos e insumos.
Numerosas investigaciones realizadas en la región del Cono Sur de Latinoamérica indican sobre prácticas específicas de manejo de suelos y cultivos que contribuirían a atenuar los impactos negativos y/o a recuperar suelos degradados (Wingeyer et al., 2015), entre ellas se pueden mencionar:
• Sistemas de manejo conservacionista como la siembra directa
• Rotaciones con pasturas
• Rotaciones de cultivos
• Uso de cultivos de cobertura (también llamados cultivos de servicio)
• Nutrición adecuada de suelos y cultivos
El desarrollo y adopción regional de sistemas agrícolas económica, social y ambientalmente sustentables debe basarse en políticas de investigación y desarrollo que contribuyan a la innovación, al conocimiento del funcionamiento (procesos y mecanismos) de los sistemas de producción, y a la formación de recursos humanos, con una visión de largo plazo y reconociendo la naturaleza compleja de estos sistemas. Las demandas de la sociedad son extremadamente dinámicas, por lo que la innovación y el conocimiento de los ecosistemas son fundamentales para adaptarnos a esas dinámicas y los cambios que conllevan para los sistemas de producción. Asimismo, existe la necesidad de múltiples tipos de materiales y programas educativos que hagan hincapié en la importancia de conservar el medio ambiente y mejorar la calidad del suelo.
Las políticas de Estado para asegurar la conservación y preservación del recurso suelo son herramientas a desarrollar e implementar en la región. Al respecto, Uruguay ha dado un excelente ejemplo con el Plan de Uso y Manejo de Suelos vigente ya desde 2013- 14 (Hill y Clerici, 2013).
Argentina, Bolivia, Brasil, Paraguay y Uruguay tienen un enorme potencial agrícola y, ante la creciente demanda mundial, deben desarrollar sistemas agrícolas que equilibren la calidad del suelo, la sostenibilidad ambiental y la producción agrícola, manteniendo al mismo tiempo beneficios económicos y sociales para todos.
El aumento de la cooperación entre el estado, la comunidad científica, los educadores, los agricultores y la sociedad no agrícola es crucial para desarrollar soluciones eficaces a largo plazo (Wingeyer et al., 2015).
Referencias
Adámoli J. 2013. Producción y ambiente: Desafíos y oportunidades. Actas CD Simposio Fertilidad 2013. Rosario, Santa Fe. IPNI-Fertilizar AC. Alexandratos, N.; y Bruinsma, J. 2012. World Agriculture towards 2030/2050: The 2012 Revision; Food and Agriculture Organization of the United Nations: Roma, Italia.
Aramburu Merlos F., J. P. Monzon, J. L. Mercau, M. Taboada, F. H. Andrade, A. J. Hall, E. Jobbagy, K. G. Cassman, y P. Grassini. 2015. Potential for crop production increase in Argentina through closure of existing yield gaps. Field Crops Research 184:145-154.
Buhaug H. y H. Urdal, 2013. An urbanization bomb? Population growth and social disorder in cities, Global Environmental Change, 23 (1): 1-10. Cassman K.G. 1999. Ecological intensification of cereal production systems: Yield potential, soil quality, and precision agriculture. Proc. National Acad. Sci. (USA) 96:5952-5959.
Caviglia O. y F. H. Andrade. 2010. Sustainable Intensification of Agriculture in the Argentinean Pampas: Capture and Use Efficiency of Environmental Resources. Am. J. Plant Sci. Biotech. 3 (Spec. Issue 1): 1-8.
FAO. 2015. http://www.fao.org/soils-2015/resources/information-material/en/.
Hill M. y C. Clerici. 2013. Avances en políticas de manejo y conservación de suelos en Uruguay. Informaciones Agronómicas de Hispanoamérica, 12:2-6.
Magrin G. 2013. Impactos del cambio climático en América Latina: Vulnerabilidad y Adaptación. Actas CD Jornadas de Conservación de Suelos AACS-INTA. Buenos Aires, Julio 2013.
Rockström, J., et al. 2009. Planetary boundaries: exploring the safe operating space for humanity. Ecol. Soc.14,32.
St.Clair S. y J. P. Lynch. 2010. The opening of Pandora’s Box: climate change impacts on soil fertility and crop nutrition in developing countries. PlantSoil, 335:101–115.
Sutton M.A., et al. 2013. Our Nutrient World: The challenge to produce more food and energy with less pollution. Global Overview of Nutrient Management. Centre for Ecology and Hydrology, Edinburgh, on behalf of the Global Partnership on Nutrient Management and the International Nitrogen Initiative.
UNEP. 2014. Assessing Global Land Use: Balancing Consumption with Sustainable Supply. A Report of the Working Group on Land and Soils of the International Resource Panel. Bringezu S., Schütz H., Pengue W., O´Brien M., Garcia F., Sims R., Howarth R., Kauppi L., Swilling M., and Herrick J. ISBN: 978-92-807-3330-3. Paris, France. www.unep.org/resourcepanel
Vilella F. y S. Renis. 2013. La demanda actual y proyectada de alimentos: El rol del sector agropecuario y sus desafíos. En M. Díaz Zorita. O. Correa, M. V. Fernández Caniggia y R. Lavado (ed.). Tercera Jornada del INBA: Aportes de la microbiología a la producción de cultivos. Ed. FAUBA. Buenos Aires. Pp. 1-9.
Wheeler T. y J. von Braun. 2013. Climate changes impacts on global food security. Science, 342:508- 513.
Wingeyer A.B., T. J. C. Amado, M. Pérez-Bidegain, G. A. Studdert, C. H. Perdomo Varela, F. O. García, y D. L. Karlen. 2015. Soil Quality Impacts of Current South American Agricultural Practices. Sustainability 2015, 7, 2213-2242; doi:10.3390/su7022213.
Presentado en el II Congreso Paraguayo de Ciencia del Suelo. Encarnación (Paraguay), 17 y 18 de Agosto de 2017. Sociedad Paraguaya de Ciencia del Suelo (SOPACIS). https://sopacis.org.py/congreso/
FUENTE: ENGORMIX











 En el caso del almacenamiento en silo bolsa es determinante mantener la hermeticidad y realizar un llenado uniforme para evitar sectores con aire en la bolsa. Para ello se debe realizar el llenado dentro del límite de estiramiento de la bolsa, reparando inmediatamente cualquier rotura para evitar la entrada de agua. Nunca confeccionar la bolsa directamente sobre el rastrojo y siempre en lotes altos para evitar los anegamientos luego de una lluvia torrencial.
En el caso del almacenamiento en silo bolsa es determinante mantener la hermeticidad y realizar un llenado uniforme para evitar sectores con aire en la bolsa. Para ello se debe realizar el llenado dentro del límite de estiramiento de la bolsa, reparando inmediatamente cualquier rotura para evitar la entrada de agua. Nunca confeccionar la bolsa directamente sobre el rastrojo y siempre en lotes altos para evitar los anegamientos luego de una lluvia torrencial.